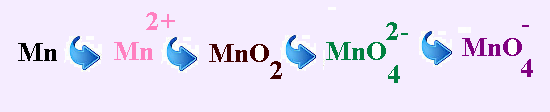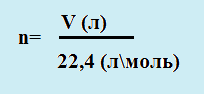Взяли стружку серебристо-белого металла.
 При
обычной температуре образцы этой стружки не взаимодействовали с водой,
концентрированной серной и азотной кислотами. Однако с разбавленной
серной кислотой реакция пошла бурно, с выделением бесцветного газа,
нерастворимого в воде. Когда для этой реакции взяли 0,135 г стружки, то
объем выделившегося газа в пересчете на н.у. составил 168 мл.
При
обычной температуре образцы этой стружки не взаимодействовали с водой,
концентрированной серной и азотной кислотами. Однако с разбавленной
серной кислотой реакция пошла бурно, с выделением бесцветного газа,
нерастворимого в воде. Когда для этой реакции взяли 0,135 г стружки, то
объем выделившегося газа в пересчете на н.у. составил 168 мл.Когда к полученному в ходе реакции раствору школьники стали добавлять раствор гидроксида натрия, то увидели, что при этом выпадает белый студенистый осадок. Однако при добавлении избытка щелочи осадок снова растворялся. Другая порция осадка также легко растворилась при добавлении соляной кислоты.
а) Какой металл исследовали? Ответ подтвердите расчетом.
б) Напишите молекулярные и ионные уравнения реакций, проведенных при исследовании раствора.
в) Чем можно объяснить, что металл хорошо растворялся в разбавленной кислоте, но не растворялся в концентрированных?