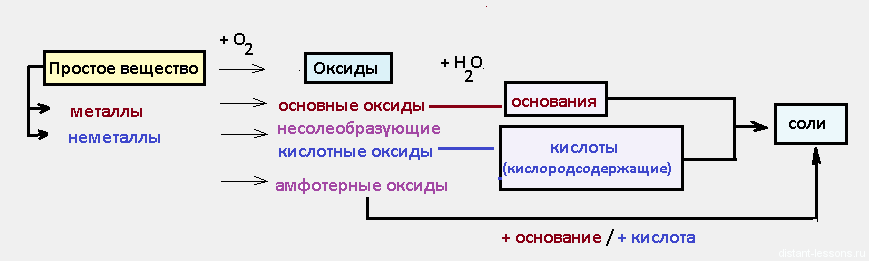
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации,температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
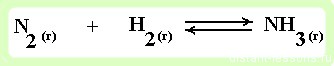
пример 1
реакция образования аммиака - протекает в газовой среде